En 1990, el profesor Richard Jorgensen, de la Universidad de Arizona en Tucson, estaba dedicado a pruebas sobre los mecanismos moleculares de la coloración, modificar genéticamente las petunias para obtener flores de un color rojo mas intenso. A partir de técnicas genéticas, Jorgensen había logrado cambiar el color de sus petunias, el color rojo estaba codificado en un gen concreto que el conocía y también como fabrica en cada flor los pigmentos que le dan el color.
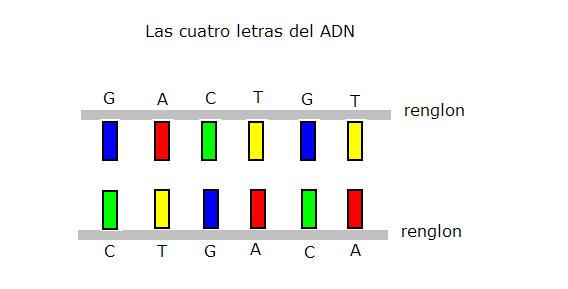
El mecanismo es el siguiente, el ADN es como un libro, donde están escritas todas las instrucciones de la planta, la escritura utiliza solo cuatro letras y se escribe a dos renglones, por duplicado, siguiendo un determinado código, si en el renglón de arriba hay una A en el de abajo pone una T y si hay una C en el de abajo pone una G, lo que se escribe en un renglón determina lo que se escribe en el otro.
Cada una de esas letras, se reconocen de una manera especial, formando pares, cada una con su complementaria, esto es, la A solo se une a la T y la C solo con la G solamente y se dice que el ADN esta ensamblado con esos dos renglones que son complementarios.
Este libro necesita de un medio que sepa leer las instrucciones que allí están escritas, un trozo de código genético puede contener la formula de una proteína por ejemplo la que da el color rojo a las flores, a este trozo que contiene la información para fabricar una proteína lo denominamos gen.
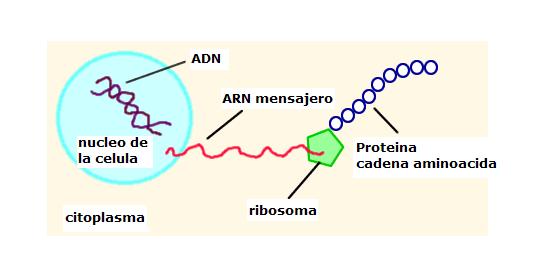
Pero hay que crear esa proteína para conseguir el color y eso es algo de lo que se encarga un sistema celular especializado fuera del núcleo, se debe transmitir la información, es decir la formula de la proteína desde el ADN hasta dicho sistema y el medio que lo hace, es un mensajero, existe una molécula llamada ARN mensajero, que es similar al ADN, excepto que tiene un solo renglón y saca una copia del gen y la lleva al sistema que crea la proteína.
El siguiente dibujo es muy esquemático y nos muestra como se realiza el proceso, donde el creador de la proteína se denomina ribosoma,
En el siguiente dibujo, se describe lo mismo con más detalle, la trascripción del ADN al ARN y a la proteína, este proceso es el fundamento de la biología molecular y es representado por cuatro etapas importantes. 1) El ADN replica su información en un proceso que implica muchas enzimas. 2) Síntesis del ARN mensajero (ARN m). 3) En las células eucariotas el ARN m es procesado y migra del núcleo al citoplasma. 4) El ARN mensajero lleva la información del código a los ribosomas, Los ribosomas son orgánulos sin membrana, sólo visibles al microscopio electrónico debido a su reducido tamaño ,29 nm en células procariotas y 32 nm en las eucariotas. Su función es ensamblar proteínas a partir de la información genética que le llega del ADN transcrita en forma de ARN mensajero (ARNm).
Proceso de interferencia de ARN. Richard Jorgensen pensó que para potenciar el color solo tenían que añadir más mensajeros del color rojo, modifico las semillas y espero a que se produjeran flores más rojas, dicho experimento fracasó, las flores no eran rojas, eran blancas.
El profesor Jorgensen sentó las bases del proceso de interferencia de ARN. Fue, en efecto, una anomalía en sus manipulaciones la que resultó ser finalmente determinante. Acostumbrado a convertir a sus petunias color malva en petunias blancas, el biólogo quiso esta vez que sus flores fueran de un malva aún más intenso. Fue allí cuando surgió la sorpresa: lo que floreció fueron flores blancas.
Hubo que aguardar al fin de los años 90 y a los primeros resultados obtenidos con un gusano y con una mosca para comprender las razones. Fueron luego los trabajos del profesor Andrew Fire (Carnegie Institute de Washington) y Craig Mello, publicados en 1998 en la revista "Nature", los que permitieron poner en evidencia la existencia del mismo fenómeno, la posibilidad de "silenciar" a un gen, en otras especies vivas.
Comprobaron que los mensajeros pueden ser de dos tipos, unos copian uno de los renglones del ADN y otros el otro renglón, cuando se ponen juntos las dos copias , forman un mensajero de doble renglón, este tipo de mensajero llamado ARN de interferencia no lleva la información de la proteína a las ribosomas, ni deja que otras moléculas las lleven, se convierte en un destructor para los mensajeros que llevan su mismo código, los rompen e impiden que así que se fabrique la proteína, es decir silencian los genes.
Fue un descubrimiento con distintos alcances, los proceso biológicos que hacen posible el funcionamiento celular son muy complejos y esta complejidad tienen mucho que ver el descifrar las funciones de los diferentes genes que están activos en la célula, para estudiar las funciones de estos genes lo que muchos investigadores trataron de hacer es silenciar o inhibir esa función y esto se consigue con técnicas y procedimientos, los investigadores descubrimiento que las células tienen mecanismos muy eficientes para silenciar la actividad de genes muy concretos y de esto se encarga el ARN interferente.
Dos equipos norteamericanos que trabajaron de forma independiente revelaron recientemente en Nature que un mecanismo como éste podría ser usado con fines terapéuticos. Uno de ellos estuvo encabezado por el argentino Raúl Andino, quien trabaja desde hace varios años en la Universidad de California. El otro equipo es de la Universidad de Massachusetts.
Otra cosa importantísima es que estos dos equipos acaban además de demostrar "in vitro" que pueden, mediante la utilización de este mecanismo, prevenir la infección de cultivos de células humanas con los virus responsables por un lado de la poliomielitis y, por otro, del sida.
Hasta mediados del siglo 20 no se sospechaba que el ácido disoxirribonucleico, ADN, fuera la molécula capaz de asegurar la transmisión de los caracteres hereditarios de célula a célula, generación tras generación. Su limitada variedad química no permitía suponer que poseyera la versatilidad y ductilidad necesarias para almacenar la información genética de los seres vivos.
En 1869 un biólogo suizo Johann Friedrich Miesscher, utilizo primero alcohol caliente y luego una pepsina enzimatica, que separa la membrana celular y el citoplasma de la célula, el científico quería aislar el núcleo celular, concretamente en los núcleos de las células del pus obtenidas de los vendajes quirúrgicos desechados y en la esperma del salmón, sometió a este material a una fuerza centrifuga para aislar a los núcleos del resto y luego sometió solo a los núcleos a un análisis químico. De esta manera Miescher identifico a un nuevo grupo de substancias celulares a las que denomino nucleínas, observo la presencia de fósforo, luego Richard Altmann las identifico como ácidos y les dio el nombre de ácidos nucleicos.
Robert Feulgen, en 1914, describió un método para revelar por tinción el ADN, basado en el colorante fucsina. Se encontró, utilizando este método, la presencia de ADN en el núcleo de todas las células eucariotas, específicamente en los cromosomas. Durante los años 20, el bioquímico P.A. Levene analizo los componentes del ADN, los ácidos nucleicos y encontró que contenía cuatro bases nitrogenadas: citosina y timina (pirimidinas), adenina y guanina (purinas); el azúcar desoxirribosa; y un grupo fosfato. También demostró que se encontraban unidas en el orden fosfato-azúcar-base, formando lo que denomino un nucleótido. Levene también sugirió que los nucleótidos se encontraban unidos por los fosfatos formando el ADN. Sin embargo, Levene pensó que se trataban de cadenas cortas y que las bases se repetían en un orden determinado. En el año 1928 Frederick Griffith investigando una enfermedad infecciosa mortal, la neumonía, estudió las diferencias entre una cepa de la bacteria Streptococcus peumoniae que producía la enfermedad y otra que no la causaba. La cepa que causaba la enfermedad estaba rodeada de una cápsula (también se la conoce como cepa S, del ingles smooth, o sea lisa, que es el aspecto de la colonia en las placas de Petri). La otra cepa (la R, de rugosa, que es el aspecto de la colonia en la placa de Petri) no tiene cápsula y no causa neumonía.
Griffith inyectó las diferentes cepas de la bacteria en ratones. La cepa S mataba a los ratones mientras que la cepa R no lo hacía. Luego comprobó que la cepa S, muerta por calentamiento, no causaba neumonía cuando se la inyectaba. Sin embargo cuando combinaba la cepa S muerta por calentamiento, con la cepa R viva, es decir con componentes individuales que no mata a los ratones e inyectaba la mezcla a los ratones, los ratones contraían la neumonía y morían.
Las bacterias que se aislaban de los ratones muertos poseían cápsula y, cuando se las inyectaba, mataban otros ratones. Frederick Griffith fue capaz de inducir la transformación de una cepa no patogénica Streptococcus pneumoniae en patogénica. Griffith postuló la existencia de un factor de transformación como responsable de este fenómeno.
El experimento de Hershey-Chase ,el ADN es el material genético.
En 1952 Alfred Hershey y Martha Chase realizaron una serie de experimentos destinados a dilucidar si el ADN o las proteínas era el material hereditario. Marcando el ADN y las proteínas con isótopos radiactivos en un cultivo de un virus, se podía seguir el camino de las proteínas y del ADN en un experimento, demostrando cual de ellos entraba en la bacteria.
Ese seria el material hereditario (factor transformador de Griffith). Dado que el ADN contiene fósforo (P) pero no azufre (S), ellos marcaron el ADN con fósforo-32 radioactivo. Por otra parte, las proteínas no contienen P pero si S, y por lo tanto se marcaron con azufre-35. Hershey y Chase encontraron que el S-35 queda fuera de la célula mientras que el P-32 se lo encontraba en el interior, indicando que el ADN era el soporte físico de la herencia.
Ver este experimento con mas detalle.
James Watson y Francis Crick
Un año después de los experimentos de Hershey-Chase apareció en la revista Nature, un artículo conjunto de Watson y Crick que narraba de forma cautelosa el descubrimiento que habían realizado; comenzaba con estas palabras:"Deseamos sugerir una estructura para la sal del ácido desoxirribonucleico (ADN).Esta estructura posee nuevas características que son de considerable interés biológico" .
Watson y Crick, escribieron en 1953, “ esta estructura tienen una novedoso caracteristica, la cual la hace tener una considerable interés biológico”.
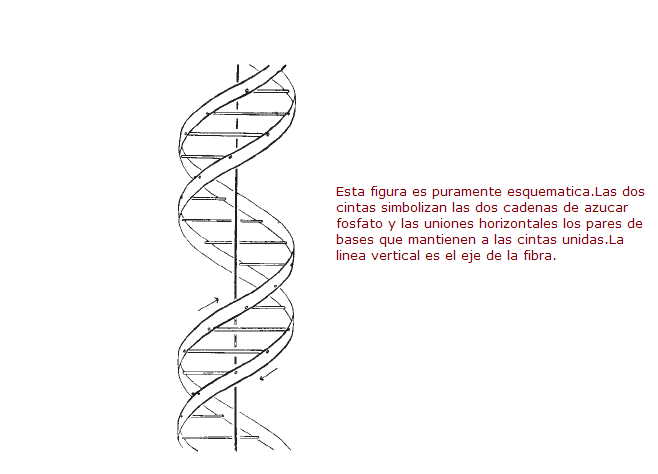
Eligiendo los datos más relevantes de un cúmulo de información y analizaron con recortes de cartón y modelos de alambre y metal, fueron capaces de develar la estructura de la doble hélice de la molécula del ácido desoxirribonucleico, ADN, y formularon los principios de almacenamiento y transmisión de la información hereditaria. Este hallazgo les valió el premio Nobel, que compartieron con M.H.F. Wilkins.
El siguiente dibujo es origina de Watson y Crack y fue tomado del articulo publicado en la revista Nature,
El análisis de la estructura del ADN consiste en averiguar la secuencia de nucleótidos. Se han desarrollado diferentes métodos para obtener la secuencia de nucleótidos del ADN, los métodos más utilizados son el de secuenciación automática y el método enzimático de terminación de cadena de Sanger también conocido por el método didesoxi.